
概要: 化学方程式计算题并不难,只要在运算时小心谨慎,保证准确性就好。另外注意有效数字要按题目的要求保留,格式要写完整,不要落掉设和答,计算过程中要带单位。下面是中考网小编针对化学方程式计算题的简单剖析,同学们可以作为参考看一看。初中化学方程式计算题解析例1、已知5gA与2gB恰好完全反应生成3gC和若干克D。若制取8gD,则需__________gA。A + B → C + D5g 2g 3g xy 8g由质量守恒定律:x=5g+2g-3g=4g,即A、D的质量比为5∶4,则可以通过计算推知y=10g答案:10例2、甲醇(CH3OH)是一种有毒、有酒的气味的可燃性液体。甲醇在氧气中不完全燃烧可发生如下反应:8CH3OH+nO2mCO2+2CO+16H2O。若反应生成3.6g水,请计算:⑴m值是__________。⑵参加反应的氧气质量是多少克?解析:此题要求运用质量守恒定律,去确定计量数。质量守恒定律不仅体现在宏观上总质量相等、元素的质量相等,还体现在微观上原子个数相等。根据碳原子数反应前后相等,8=m+2,m=6;反应前后氧原子个数为8+2n=6&time
初中化学方程式计算题解析,标签:九年级化学练习题,http://www.kgf8.com化学方程式计算题并不难,只要在运算时小心谨慎,保证准确性就好。另外注意有效数字要按题目的要求保留,格式要写完整,不要落掉设和答,计算过程中要带单位。下面是中考网小编针对化学方程式计算题的简单剖析,同学们可以作为参考看一看。
初中化学方程式计算题解析
例1、已知5gA与2gB恰好完全反应生成3gC和若干克D。若制取8gD,则需__________gA。
A + B → C + D
5g 2g 3g x
y 8g
由质量守恒定律:x=5g+2g-3g=4g,即A、D的质量比为5∶4,则可以通过计算推知y=10g
答案:10
例2、甲醇(CH3OH)是一种有毒、有酒的气味的可燃性液体。甲醇在氧气中不完全燃烧可发生如下反应:8CH3OH+nO2![]() mCO2+2CO+16H2O。若反应生成3.6g水,请计算:
mCO2+2CO+16H2O。若反应生成3.6g水,请计算:
⑴m值是__________。
⑵参加反应的氧气质量是多少克?
解析:
此题要求运用质量守恒定律,去确定计量数。质量守恒定律不仅体现在宏观上总质量相等、元素的质量相等,还体现在微观上原子个数相等。根据碳原子数反应前后相等,8=m+2,m=6;反应前后氧原子个数为8+2n=6×2+2+16,n=11,然后根据化学方程式,由生成3.6g水,求参加反应的氧气质量。
答案:
(1)6;
(2)8+2n = 6×2+2+16,n =11
设参加反应的氧气质量为x,
8CH3OH + 11O2![]() 6CO2 + 2CO + 16H2O
6CO2 + 2CO + 16H2O
11×32 16×18
x 3.6g
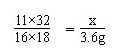
x=4.4g
答:参加反应的氧气为4.4g。
例3、如图表示等质量的金属Mg和Al分别与足量且质量分数相等的稀硫酸反应,下列叙述正确的是( )
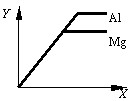
A.X表示反应所用时间,Y表示生成氢气的质量
B.X表示生成氢气的质量,Y表示反应所用时间
C.X表示滴加稀硫酸的质量,Y表示生成氢气的质量
D.X表示参加反应的金属的质量,Y表示生成氢气的质量
解析:
此题要求分析金属与酸反应中各种量之间的变化关系,涉及到金属的质量、酸的量、金属的活泼性、反应的速率、氢气的质量以及反应时间等多种量的变化。由题意,等质量的金属Mg和Al与足量且质量分数相等的酸反应,产生氢气的速率Mg>Al,产生氢气的总量Mg〈AL,即产生等量氢气,Mg所用反应时间少,A、B选项是错误的。同时,产生等量氢气,所需金属的质量Al〈Mg,D选项错误。
答案:C
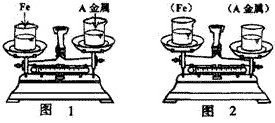
例4、在托盘天平两边各放一只烧杯,调节至平衡。在两只烧杯里注入相同质量、相同质量分数的足量稀盐酸,然后分别向左右两端烧杯中加入质量相等的Fe和金属A。有气体产生时,天平指针慢慢向左偏转(如图1);指针偏转到一定角度后,又慢慢向右偏转;反应结束,天平指针指向右端(如图2)。则天平右端加入的金属A可能是( )
A.Zn
B.Mg
C.Cu
D.Al
解析:
此题将金属与酸反应引起的质量变化以天平是否平衡来体现,天平平衡本身就隐含着质量相等这一等式关系,即m金属-mH2=m’金属-m’H2
本题盐酸的量充足,且等质量、等质量分数,加入等质量的金属A时,指针向左偏转,由上述等式关系,说明金属A产生H2的速率快,即金属A的活泼性,强于铁。反应结束后,天平指针指向右端,说明金属产生氢气的总量A〈Fe,即相对原子质量A>Fe,符合题意的选项为Zn。
答案:A
例5、一氧化碳能在高温下还原铁矿石中的氧化铁。现用200t 含氧化铁80%的铁矿石炼铁,可炼出含铁95%的生铁多少吨?
⑴请你根据化学方程式进行计算。
⑵本题还有其他解法吗?若有,只要求说明依据并列出算式。若没有,可不回答此问。
解析:
此题为不纯物的计算题。解题时,以Fe2O3的质量代入化学方程式计算。其质量为200t×80%=160t。本题也可按铁元素质量守恒,根据化学式计算,也可按物质之间的质量比由化学方程式计算。
答案:
(1)设可炼出生铁的质量为x,
3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
160 2×56
200t×80% x×95%
列式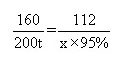
 保存 |
保存 |
 打印 |
打印 |
 关闭
关闭